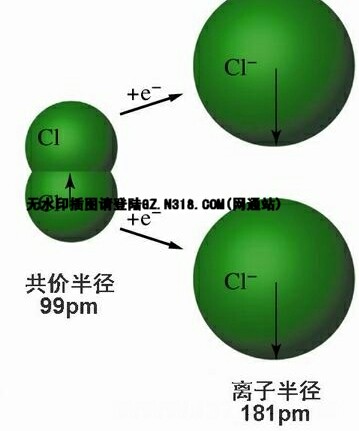
1、同一元素的微粒,电子数越多,半径越大。如钠原子>钠离子,氯原子<氯离子
2、同一周期内元素的微粒,阴离子半径大于阳离子半径。如氧离子>锂离子
3、同类离子与原子半径比较相同。如钠离子>镁离子>铝离子,氟离子<氯离子<溴离子
4、具有相同电子层结构的离子(单核),核电荷数越小,半径越大。如氧离子>氟离子>钠离子>镁离子>铝离子 硫离子>氯离子>钾离子>钙离子
5、同念含一元素高价阳离子半径小于低价阳离子半径,又小于金属的原子半径。如铜离子<亚铜离子<铜原子 负二价硫>硫原子>四价硫>六价硫
描述离子大小的参数。取决于离子所带电荷、电子分布和晶体结构型式。设r阳为阳离子半径,r阴为阴离子半径。r阳+r阴=键长。r阳/r阴与晶体类型有关。可从键长计算离子半径。
一般采用Goldschmidt半径和Pauling半径,皆是NaCl型结构配位数为6的数据。Shannon考虑了配位数和电子自旋状态的影响,得到两套最新数碧高银据,其中一套数据,参考电子云密度图,阳离子半径比传统数据大悔宴14pm,阴离子小14pm,更接近晶体实际。